EL PETROLEO
¿Que es el petroleo? Es una mezcla homogenea de compuestos orgánicos (hidrocarburos insolubles en agua).
Fruto de la transformación de materia orgánica procedente de depositos de grandes cantidades en fondos anoxicos de mares, zonas lacustres del pasado geologico.
En condiciones normales que puede presentar gran variación en diversos parámetros como color y viscosidad, densidad,capacidad calorífica, etc...
Es un recurso natural no renovable y actualmente también es la principal fuente de energía en los países desarrollados.
El petróleo está formado principalmente por hidrocarburos, en su mayoría parafinas, naftenos y aromáticos.
CLASIFICACION DEL PETROLEO.
CRUDOS DE REFERENCIA. Compuesto de quince crudos procedentes de campos de extracción en los sistemas Brent y Ninian de los campos del Mar del Norte, este crudo se almacena y carga en la terminal de las Islas Shetland. La producción de crudo de Europa, África y Oriente Medio sigue la tendencia marcada por los precios de este crudo
CRUDO LIVIANO O LIGERO. Tiene gravedades API mayores a 31,1 °API.
CRUDO MEDIO O MEDIANO. Tiene gravedades API entre 22,3 y 31,1 °API.
CRUDO PESADO. Tiene gravedades API entre 10 y 22,3 °API.
CRUDO EXTRAPESADO. Gravedades API menores a 10 °API.
PROCESO DE PERFORACION.
El Proceso de perforación de pozos petroleros y de gas natural se realiza exclusivamente en las etapas de Exploración y Desarrollo, lo quese conoce como "Upstream".
La extracción es una actividad de la última etapa del Upstream, denominada Producción.
Si la presión de los fluidos es suficiente, forzará la salida natural del petróleo a través del pozo que se conecta mediante una red de oleoductos hacia su tratamiento primario, donde se deshidrata y estabiliza eliminando los compuestos más volátiles.
Se transporta a refinerías o plantas de mejoramiento.
Los componentes químicos del petróleo se separan y obtienen por destilación mediante un proceso de refinamiento, extrayendo diferentes productos, entre otros: propano, butano, gasolina, queroseno, gasóleo, aceites lubricantes, asfaltos, carbón de coque, etc.
EL REFINADO DEL PETROLEO.
Muy a menudo la calidad de un Petróleo crudo depende en gran medida de su origen .
El crudo a pie de pozo no puede ser utilizado tal cual, por tanto, indispensable la utilización de diferentes procesos de tratamiento y transformación para la obtención del mayor número de productos de alto valor comercial. El conjunto de estos tratamientos constituyen el proceso de refino de petróleo o refinación del petróleo.
DESTILACION FRACCIONADA DEL PETROLEO.
El petróleo naturalse separa en mezclas más simples de hidrocarburos que tienen usos específicos, a este proceso se le conoce como destilación fraccionada.
El petróleo natural hervientese introduce
 a la parte baja de la torre,
todas las sustancias
a la parte baja de la torre,
todas las sustancias
que se evaporan a esa temperatura pasan como
vapores a la cámara superior algo más fría y en
ella se condensan las fracciones más pesadas que
corresponden a los aceites lubricantes.
DERIVADOS DEL PETROLEO.
Un derivado del petróleo es un producto procesado en una refinería, usando como materia prima el petróleo; pueden producir distintos productos derivados del petróleo.
La mayor parte del crudo es usado como materia prima para obtener energía, por ejemplo la gasolina, y tambien producen sustancias químicas, que se puede utilizar en procesos químicos para producir plástico (derivado que sera explicado a continuacion) y/o otros materiales útiles.
PLASTICO.
¿Que es el plastico? El término plástico en su significación más general, se aplica a las sustancias de similares estructuras que carecen de un punto fijo de evaporación y poseen durante un intervalo de temperaturas propiedades de elasticidad y flexibilidad que permiten moldearlas y adaptarlas a diferentes formas y aplicaciones. Nombra ciertos tipos de materiales sintéticos obtenidos mediante fenómenos de polimerización o multiplicación semi-natural de los átomos de carbono en las largas cadenas moleculares de compuestos orgánicos derivados del petróleo y otras sustancias naturales.
PROPIEDADES Y CARACTERISTICAS.
Los plásticos proporcionan el balance necesario de propiedades que no pueden lograrse con otros materiales por ejemplo: color, poco peso, tacto agradable y resistencia a la degradación ambiental y biológica.
- fáciles de trabajar y moldear,
- tienen un bajo costo de producción,
- poseen baja densidad,
- suelen ser impermeables,
- buenos aislantes eléctricos,
- aceptables aislantes acústicos,
- buenos aislantes térmicos, aunque la mayoría no resisten temperaturas muy elevadas,
- resistentes a la corrosión y a muchos factores químicos;
- algunos no son biodegradables ni fáciles de reciclar, y si se queman, son muy contaminantes.

PROCESO PRODUCTIVO.
La primera parte de la producción de plásticos consiste en la elaboración de polímeros en la industria química. Parte de los plásticos determinados por la industria se usan directamente en forma de grano o resina. Se utilizan varias formas de moldeo (por inyección, compresión, rotación, inflación, etc.) o la extrusión de perfiles o hilos. Parte del mayor proceso de plásticos se realiza en un horno.
CLASIFICACION DE LOS PLASTICOS.
- MONOMERO BASE (NATURALES). Son los polímeros cuyos monómeros son derivados de productos de origen
natural con ciertas características como, por ejemplo, la celulosa, la caseína y el caucho.Dentro de dos de estos ejemplos existen otros plásticos de los cuales provienen:
- Los derivados de la celulosa son: el celuloide, el celofán y el cellón.
- Los derivados del caucho son: la goma y la ebonita.
- Sintéticos: Son aquellos que tienen origen en productos elaborados por el hombre, principalmente derivados del petróleo como lo son las bolsas de polietileno
- COMPORTAMIENTO FRENTE AL CALOR.
- TERMOPLSTICOS. Plástico que, a temperatura ambiente, es plástico o deformable, se convierte en un líquido cuando se calienta y se endurece en un estado vítreo cuando se enfría suficiente.Difieren de los polímeros termoestables en que después de calentarse y moldearse éstos pueden recalentarse y formar otros objetos, ya que en el caso de los termoestables o termoduros, su forma después de enfriarse no cambia y este prefiere incendiarse.
- TERMOESTABLES. Son materiales que una vez que han sufrido el proceso de calentamiento-fusión y formación-solidificación, se convierten en materiales rígidos que no vuelven a fundirse. Generalmente para su obtención se parte de un aldehído.
Existe una gran variedad de plásticos y para clasificarlos, se usa un sistema de codificación que se muestra en la Tabla 1. Los productos llevan una marca que consiste en el símbolo internacional de reciclado
El número presente en el código, está designado arbitrariamente para la identificación del polímero del que esta hecho el plástico y no tiene nada que ver con la dificultad de reciclaje ni dureza del plástico en cuestión.
| Tipo de plástico: | Polietileno Tereftalato | Polietileno de alta densidad | Policloruro de vinilo | Polietileno de baja densidad | Polipropileno | Poliestireno | Otros |
|---|---|---|---|---|---|---|---|
| Acrónimo | PET | PEAD/ HDPE | PVC | PEBD/ LDPE | PP | PS | Otros |
| Código | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
 RECICLADO.
RECICLADO. Se ha establecido el reciclado de tales productos de plástico, que ha consistido básicamente en recolectarlos, limpiarlos, seleccionarlos por tipo de material y fundirlos de nuevo para usarlos como materia prima adicional, alternativa o sustituta para el moldeado de otros productos.
De esta forma la humanidad ha encontrado una forma adecuada para evitar la contaminación de productos que por su composición, materiales o componentes, no son fáciles de desechar de forma convencional.
PLASTICOS BIODEGRADABLES.
La sustitución de los plásticos actuales por plásticos biodegradables es una vía por la cual el efecto contaminante de aquellos, se vería disminuido en el medio ambiente. Los desechos de plásticos biodegradables pueden ser tratados como desechos orgánicos y eliminarlos en los depósitos sanitarios, donde su degradación se realice en exiguos períodos de tiempo.
Los polímeros biodegradables se pueden clasificar de la siguiente manera:
- Polímeros extraídos o removidos directamente de la biomasa: polisacáridos como almidón y celulosa. Proteínas como caseína, queratina, y colágeno.
- Polímeros producidos por síntesis química clásica utilizando monómeros biológicos de fuentes renovables.
- Polímeros producidos por microorganismos, bacterias productoras nativas o modificadas genéticamente.
HIDROCARBUROS
Los hidrocarburos son compuestos de carbono e hidrógeno que, atendiendo a la naturaleza de los enlaces, pueden clasificarse de la siguiente forma:
Hidrocarburos:
- Alifàticos:
- Saturados:
-Alcanos - Insaturados:
-Alquenos
-Alquinos
- Aromàticos.
ALCANOS
Tipos de alcanos
Los alcanos son hidrocarburos (formados por carbono e hidrógeno) que solo contienen enlaces simples carbono-carbono. Se clasifican en lineales, ramificados, cíclicos y policíclicos.
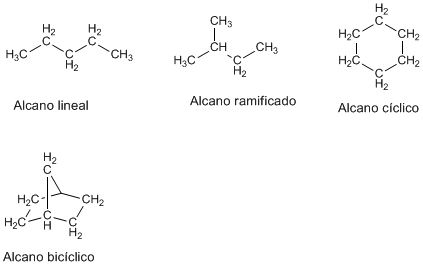
Serie homóloga
Los alcanos lineales forman una serie homologa ya que sólo difieren en el número de -CH2- y pueden obtenerse a partir de una formula general: CH3-(CH2)n-CH3Isómeros
Se llaman isómeros a compuestos que tienen la misma fórmula molecular pero diferente estructura. El butano y el 2-metilpropano son isómeros de formula C4H10.
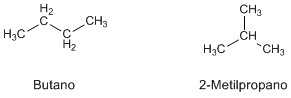
Nomenclatura de alcanos
Estructura del nombre
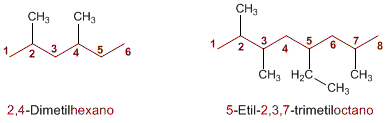
El nombre de un alcano está compuesto de dos partes, un prefijo que indica el número de carbonos de la cadena seguido del sufijo -ano que caracteriza este tipo de compuestos, (met-ano, et-ano, prop-ano, but-ano).Elección de la cadena principal
Encontrar y nombrar la cadena más larga de la molécula. Si la molécula tiene dos o más cadenas de igual longitud, la cadena principal será la que tenga el mayor número de sustituyentes.
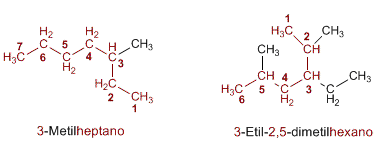
Numeración de la cadena principal
Numerar los carbonos de la cadena más larga comenzando por el extremo más próximo a un sustituyente. Si hay dos sustituyentes a igual distancia de los extremos, se usa el orden alfabético para decidir cómo numerar.
Formación del nombre
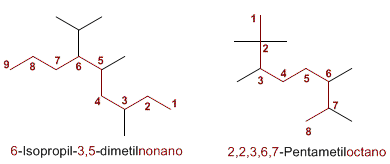
El nombre del alcano se escribe comenzando por el de los sustituyentes en orden alfabético con los respectivos localizadores, y a continuación se añade el nombre de la cadena principal. Si una molécula contiene más de un sustituyente del mismo tipo, su nombre irá precedido de los prefijos di, tri, tetra, ect.
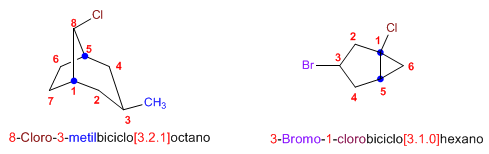
Nomenclatura de Biciclos
Regla 1. El nombre de un biciclo se construye con la palabra Biciclo seguida de un corchete en el que se indica el número de carbonos de cada una de las tres cadenas que parten de los carbonos cabeza de puente, terminando en el nombre del alcano de igual número de carbonos.
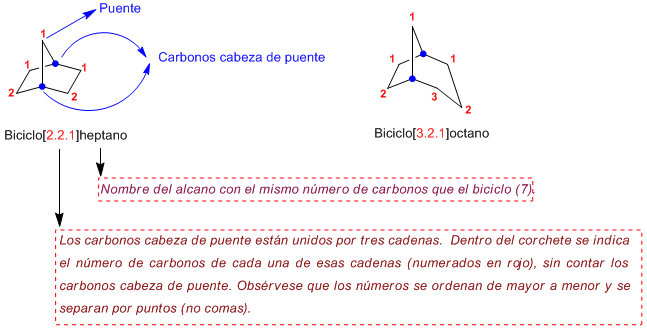
Regla 2. La numeración parte de un carbono cabeza de puente y prosigue por la cadena más larga hasta el segundo cabeza de puente, a continuación se numera la cadena mediana y por último el puente (cadena más pequeña)
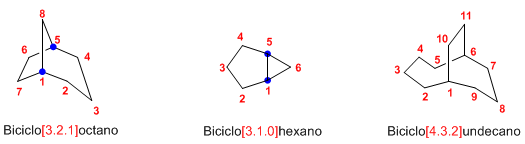
Regla 3. Los sustituyentes se ordenan alfabéticamente, precedidos por localizadores que indican su posición en el biciclo y se colocan delante de la palabra biciclo.
Propiedades físicas de los alcanos
Los puntos de fusión y ebullición de alcanos son bajos y aumentan a medida que crece el número de carbonos debido a interacciones entre moléculas por fuerzas de London. Los alcanos lineales tienen puntos de ebullición más elevados que sus isómeros ramificados.
En los alcanos, los puntos de fusión aumentan al aumentar el tamaño molecular, a mayor superficie se produce una mayor atracción debido a las fuerzas de London.Puntos de ebullición en alcanos
Los puntos de ebullición también aumentan con el peso molecular, cuanto más pesada es una molécula más energía requiere para pasar del estado líquido al gaseoso.
Alcanos lineales y ramificados
Los alcanos ramificados poseen superficies más pequeñas que sus isómeros lineales, por lo que las fuerzas atractivas son menores, dando lugar a puntos de fusión y ebullición mas bajos.
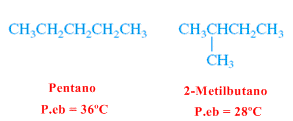
El 2-metilbutano (alcano ramificado) tiene un punto de ebullición menor que el pentano (alcano lineal)
Solubidad en agua
Los alcanos son insolubles en agua dada su casi nula polaridad. Sus densidades se situan entre 0.6 y 0.8 g/ml por lo que flotan en el agua.
Los alcanos de menor tamaño, metano, etano, propano y butano son gases a temperatura ambiente. Los alcanos lineales desde C5H12 hasta C17H36 son líquidos. Alcanos de mayor número de carbonos son sólidos a temperatura ambiente.
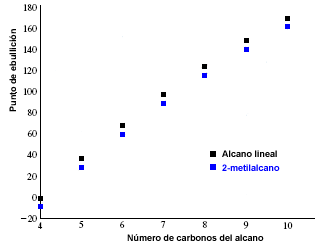
Los puntos de fusión y ebullición de los alcanos aumentan con el número de carbonos de la molécula. También se observa que los alcanos ramificados presentan un punto de ebullición menor que sus isómeros lineales.
En la siguiente gráfica se representan los puntos de ebullición de alcanos lineales (en negro) y los correspondientes a sus 2-metilalcanos isómeros (en azul).
En moléculas neutras, como son los alcanos, las fuerzas atractivas son debidas a interacciones de van der Waals que pueden ser de tres tipos: interacciones dipolo – dipolo, dipolo – dipolo inducido y dipolo inducido – dipolo inducido.
La formación de los dipolos inducidos que producen la atracción entre moléculas neutras puede verse en el siguiente esquema:
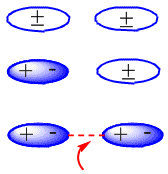
interacción dipolo inducido - dipolo inducido
Consideremos los isómeros del pentano, como ejemplo de la disminución en el punto de ebullición, al pasar de alcanos lineales a ramificados.
El pentano tiene una importante área superficial que permite gran número de interacciones dipolo inducido – dipolo inducido. El 2-Metilbutano es más compacto y posee menor área superficial, menos interacciones intermoleculares y menor punto de ebullición.
Isómeros conformacionales
Los alcanos no son rígidos debido al giro alrededor del enlace C-C. Se llaman conformaciones a las múltiples formas creadas por estas rotaciones.
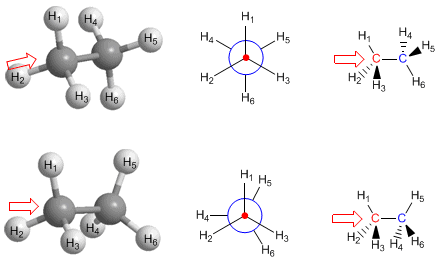
En el modelo molecular del etano representado a la derecha, podemos ver que los metilos pueden girar fácilmente uno respecto al otro. La energía necesaria para este giro, es de tan solo 3 kcal/mol. Se puede decir que hay rotación libre alrededor de los enlaces simples.Conformaciones alternada y eclipsada del etano
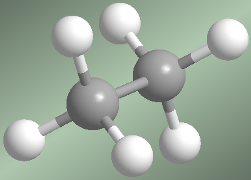 Hay dos maneras de dibujar la molécula de etano: la conformación alternada y la eclipsada. En la conformación alternada cada átomo de hidrógeno del primer carbono se encuentra situado entre dos átomos de hidrógeno del segundo carbono, lo que evita repulsiones y hace que esta conformación sea de baja energía. En la conformación eclipsada todos los átomos de hidrógeno del primer carbono se hallan enfrentados a los del segundo. La rotación del metilo entorno al enlace C-C, permite el
Hay dos maneras de dibujar la molécula de etano: la conformación alternada y la eclipsada. En la conformación alternada cada átomo de hidrógeno del primer carbono se encuentra situado entre dos átomos de hidrógeno del segundo carbono, lo que evita repulsiones y hace que esta conformación sea de baja energía. En la conformación eclipsada todos los átomos de hidrógeno del primer carbono se hallan enfrentados a los del segundo. La rotación del metilo entorno al enlace C-C, permite el 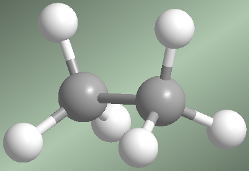 paso de la conformación alternada a la eclipsada y viceversa.
paso de la conformación alternada a la eclipsada y viceversa.Las múltiples formas del etano creadas por rotación alrededor del enlace C-C son conformaciones y el estudio de las mismas se denomina análisis conformacional.
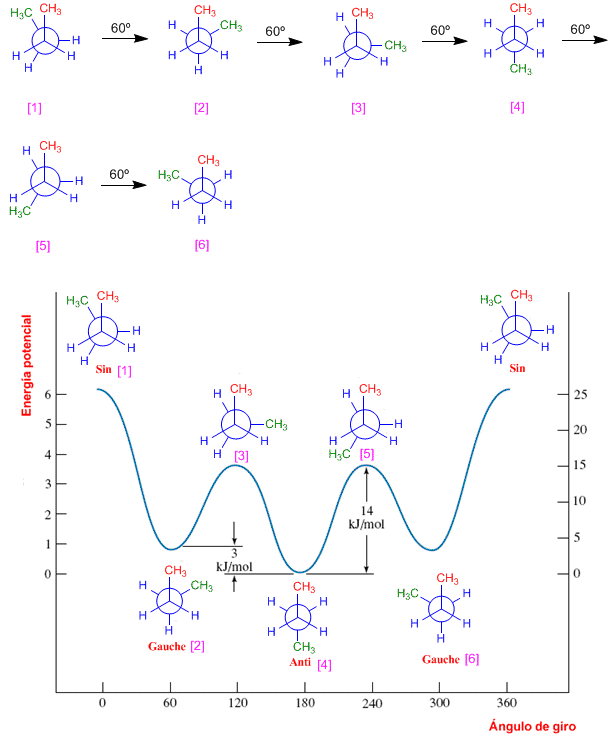
Isómeros conformacionales del butano
En el butano la rotación alrededor del enlace C2-C3 también genera conformaciones alternadas y eclipsadas, entre las que destacan: conformación sin, conformación anti y conformación gauche En estos modelos moleculares se representan las conformaciones anti, sin y gauche del butano.
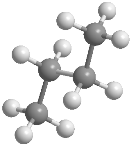
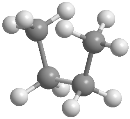
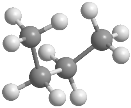
La conformación anti es la de mayor estabilidad del butano, los grupos metilo están alejados y no interaccionan. La conformación gauchees de menor estabilidad, en ella existe una interacción entre metilos que están situados a 60º, llamada interacción gauche.
Proyección de Newman
La energía de las diferentes conformaciones puede verse en las proyecciones de Newman. Así en el caso del etano la conformación eclipsada es la de mayor energía, debido a las repulsiones entre hidrógenos.
La proyección de Newman se obtiene al mirar la molécula a lo largo del eje C-C. El carbono frontal se representa por un punto, del que parten los tres enlaces que lo unen a los sustituyentes. El carbono de atrás se representa por un círculo y los enlaces que salen de este carbono se dibujan a partir de este círculo.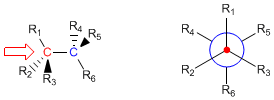
Proyección de Newman del etano alternado y eclipsado
Las conformaciones del etano se pueden representar fácilmente con esta proyección. En el caso de la conformación eclipsada para hacer mas visibles los tres hidrógenos posteriores, éstos se dibujan ligeramente girados respecto a la posición totalmente eclipsada.
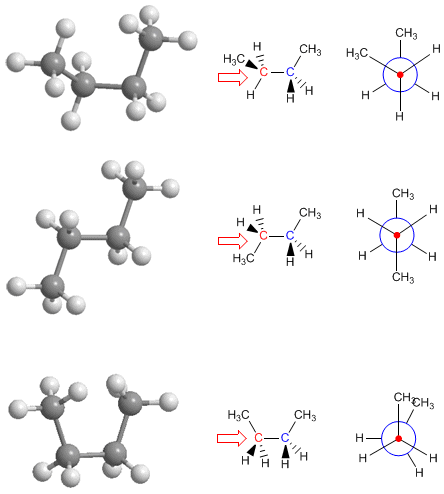
Proyección de Newman para las conformaciones del butano
En la columna derecha se incluyen las conformaciones sin, anti y gauche del butano, con sus respectivas proyecciones de Newman, en las que se pueden observar las interacciones entre grupos metilo. La conformación más estable es la anti (no presenta repulsiones metilo-metilo), siendo la conformación sin la de mayor inestabilidad (energía elevada) debido al eclipsamiento metilo-metilo.
Diagramas de energía potencial
Las diferentes conformaciones de los alcanos se puede representar en un diagrama de energía potencial donde podemos ver que conformación es más estable (mínima energía) y la energía necesaria para pasar de unas conformaciones a otras.
Diferencia de energía entre conformaciones
 Las diversas conformaciones del etano no tienen la misma energía, esto se debe a la repulsión electrónica entre hidrógenos. Cuando vamos girando la molécula a partir de una conformación alternada, la distancia entre los átomos de hidrógenos de los respectivos grupos metilo empieza a disminuir, produciendo un aumento de la repulsión entre los pares de electrones enlazantes de los enlaces C-H. La energía potencial del sistema aumenta hasta llegar a la conformación eclipsada.
Las diversas conformaciones del etano no tienen la misma energía, esto se debe a la repulsión electrónica entre hidrógenos. Cuando vamos girando la molécula a partir de una conformación alternada, la distancia entre los átomos de hidrógenos de los respectivos grupos metilo empieza a disminuir, produciendo un aumento de la repulsión entre los pares de electrones enlazantes de los enlaces C-H. La energía potencial del sistema aumenta hasta llegar a la conformación eclipsada.Diagrama de energía potencial del etano
Las diferencias de energía entre las distintas conformaciones pueden verse representando gráficamente la energía de cada conformación frente al ángulo girado. Como puede observarse en el diagrama del etano, las conformaciones eclipsadas son los máximos de energía y las alternadas los mínimos.
Para obtener el diagrama de energía potencial del etano partimos de la conformaciòn eclipsada y vamos realizando giros de 60º hasta recorrer los 360º.
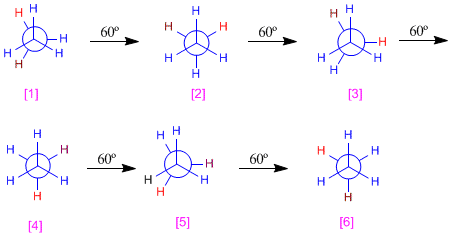
Clasificamos las distintas conformaciones según energía. Las alternadas [1], [3] y [5] tienen la misma energía, que llamaremos E1 (en el diagrama la tomaremos como cero). Las conformaciones [2], [4] y [6] tienen más energía debido a los eclipsamientos hidrógeno-hidrógeno. Estas conformaciones eclipsadas están unas 12 KJ/mol por encima de las alternadas.
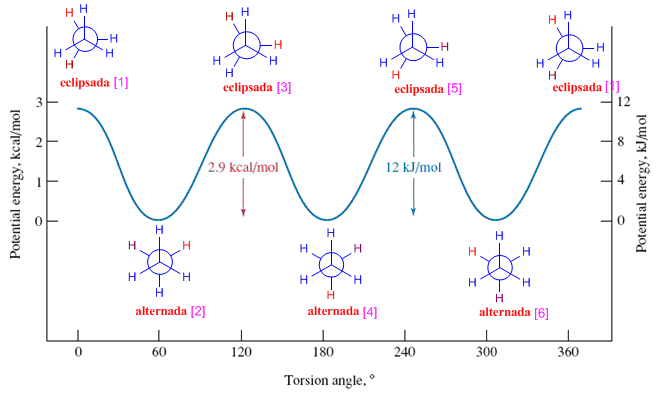
Diagrama de energía potencial del butano
En el diagrama del butano existen mas conformaciones que una alternada y una eclipsada. La conformación alternada que tiene los metilos lo más lejos posible uno del otro se llama anti [4] y es la más estable, al tener las mínimas repulsiones. La rotación del carbono de atrás 60º da lugar a una eclipsada [5] con dos interacciones metilo-hidrógeno, un nuevo giro da lugar a otra alternada llamada gauche [6]. Un tercer giro deja los metilos enfrentados (eclipsados) se denomina conformación sin [1] y es la de mayor energía potencial.
Combustión de alcanos
Dada su escasa reactividad los alcanos también se denominan parafinas. Las reacciones más importantes de este grupo de compuestos son las halogenaciones radicalarias y la combustión. La combustión es la combinación del hidrocarburo con oxígeno, para formar dióxido de carbono y agua.
El proceso de la combustión
La combustión es un proceso general de todas las moléculas orgánicas, en la cual los átomos de carbono de la molécula se combinan con el oxígeno convirtiéndose en moléculas de dióxido de carbono (CO2) y los átomos de hidrógeno en agua líquida (H2O). La combustión es una reacción exotérmica, el calor desprendido se llama calor de combustión y en muchos casos puede determinarse con exactitud, lo que permite conocer el contenido energético de las moléculas.Reaccion de combustión ajustada
Estabilidad de isómeros
Comparando calores de combustión de alcanos isómeros se observa que sus valores no son iguales. Así el 2-metilpropano desprende en su combustión -685.4 kcal/mol, mientras que el butano desprende -687.4 kcal/mol. Estos datos demuestran que el butano tiene un contenido energético superior al 2-metilpropano y por tanto es termodinámicamente menos estable.
ALQUENOS.
Los alquenos abundan en la naturaleza. El eteno, es un compuesto que controla el crecimiento de las plantas, la germinación de las semillas y la maduración de los frutos.
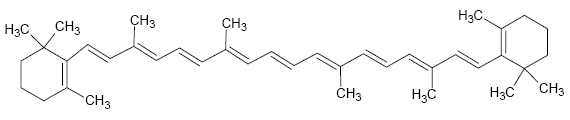
El α−Pineno es una fragancia obtenida a partir de los pinos. β-Caroteno es un compuesto que contiene 11 dobles enlaces y es precursor de la vitamina A.
Eteno: una hormona de las plantas
Limoneno: componente del zumo de naranjas y limones
Felandreno: aceite de los eucaliptos
Nomeclatura de alquenos
| Los alquenos se nombran reemplazando la terminación -ano del correspondiente alcano por -eno. Los alquenos más simples son el eteno y el propeno, también llamados etileno y propileno a nivel industrial.
Regla 1.- Se elige como cadena principal la de mayor longitud que contenga el doble enlace. La numeración comienza en el extremo que otorga al doble enlace el menor localizador.

Regla 2.- El nombre de los sustituyentes precede al de la cadena principal y se acompaña de un localizador que indica su posición en la molécula. La molécula se numera de modo que el doble enlace tome el localizador más bajo.

Regla 3.- Cuando hay varios sustituyentes se ordenan alfabéticamente y se acompañan de sus respectivos localizadores

Regla 4.- Cuando el doble enlace está a la misma distancia de ambos extremos, se numera para que los sustituyentes tomen los menores localizadores.

Regla 5.- En compuestos cíclicos resulta innecesario indicar la posición del doble enlace, puesto que siempre se encuentra entre las posiciones 1 y 2.

Grado de insaturacion
|
2-Buteno: Hidrocarburo insaturado
Debido a que los alcanos contienen el máximo número posible de enlaces carbono-hidrógeno, se dice de ellos que son hidrocarburos saturados. Alquenos y compuestos cíclicos son hidrocarburos insaturados.
Butano, un hidrocarburo saturado
2-Buteno, un hidrocarburo insaturado
El número total de enlaces π y ciclos en una molécula se donomina grado de insaturación. 
2-metil-1,3-butadieno (dos dobles enlaces, dos grados de insaturación)
Ciclohexeno ( un doble enlace y un ciclo, dos grados de insaturación)
![biciclo[3.3.0]nonano biciclo[3.3.0]nonano](http://www.quimicaorganica.org/images/stories/organica-i/alquenos/insaturaciones/biciclo330nonano.gif)
Biciclo[3.3.0]nonano (dos ciclos, dos grados de insaturación)
{xtypo_info}Grado de insaturación en compuestos que continenen halógenos, oxígenos y nitrógenos. Halógenos: Sumar el número de halógenos al número de hidrógenos. Oxígenos: Ignorar los oxígenos. Nitrógenos: Restar el número de nitrógenos del número de hidrógenos.{/xtypo_info}
Ejemplo 1: Calcular el grado de insaturación en las siguientes fórmulas:
a) C4H8 Solución: Un alcano saturado de 4 carbonos tiene de fórmula C4H10. El compuesto tiene un par de hidrógenos menos, así que, su grado de insaturación es uno. b) C9H16Br2 Solución: Sumamos los halógenos a los hidrógenos obteniéndose la fórmula C9H18. Un alcano saturado de 9 carbonos tiene de fórmula C9H20. El compuesto tiene una insaturación. |
Estructura y enlace
os siguientes modelos muestran la estructura, distancias y ángulos de enlace del eteno. Cada uno de los carbonos de la molécula tiene hibridación sp2. Su geometría es plana, con ángulos de enlace próximos a los 120º.
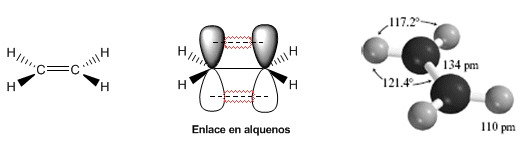
El doble enlace está formado por un enlace s que se obtiene por solapamiento de los orbitales híbridos sp2, y un enlace pformado por solapamiento de orbitales p que no hibridaron (orbitales p puros).
El doble enlace es más fuerte y corto que el simple. La energía del doble enlace en el eteno es de 605 KJ/mol frente a los 368 KJ/mol del enlace simple carbono-carbono en el etano.
Propiedades fisicas
Los alquenos presentan puntos de fusión y ebullición próximos a los alcanos correspondientes.
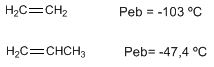
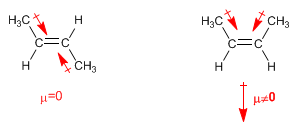
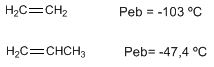
Momento dipolar en alquenos.
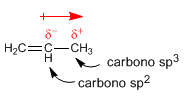
El carbono sp2 tiene más carácter s que el carbono sp3, los electrones en el orbital s están más próximos al núcleo y son atraídos fuertemente por éste, de modo que un carbono sp2 tiene tendencia a atraer hacia si electrones, lo que genera momentos dipolares.

En alquenos trans los momentos dipolares se restan, llegando a anularse en el caso de que ambos carbonos tengan cadenas iguales. En los alquenos cis los momentos dipolares se suman dando lugar a un momento dipolar total distinto de cero (molécula polar)
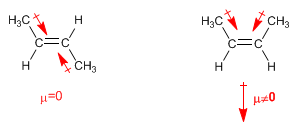
Estabilidad
Los calores desprendidos en las siguientes reacciones de hidrogenación, nos dan una idea sobre la diferente estabilidad de los alquenos.
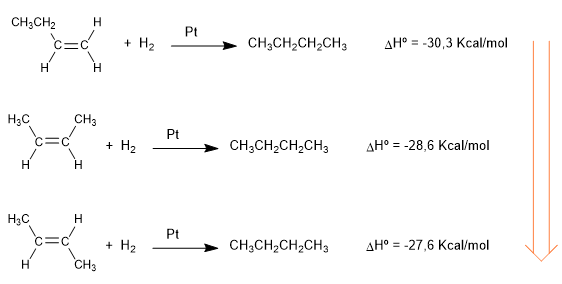

Los tres alquenos hidrogenan para dar el mismo alcano (butano). El 1-buteno es el alqueno que más energía desprende en la hidrogenación, por ello, es el más inestable (tiene más energía). Los cis y trans-1-buteno tienen una mayor estabilidad por ser alquenos más sustituidos. La interacción entre las cadenas que rodean el alqueno y el doble enlace (hiperconjugación) lo estabiliza, disminuyendo su energía.
Como puede observarse el cis-2-buteno es mas inestable que el trans, debido a las repulsiones estéricas entre metilos.
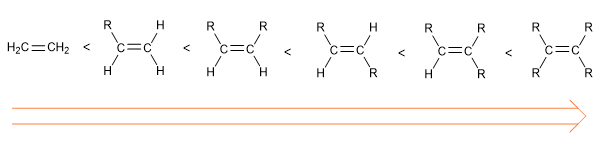
El orden de estabilidad de los alquenos es el siguiente:

Síntesis de alquenos mediante E2
Los alquenos pueden prepararse a partir de haloalcanos y sulfonatos de alquilo mediante eliminación bimolecular (E2). En el siguiente ejemplo el 2-bromo-2-metilbutano reacciona con metóxido de sodio para formar una mezcla de 2-metil-2-buteno y 2-metil-1-buteno.
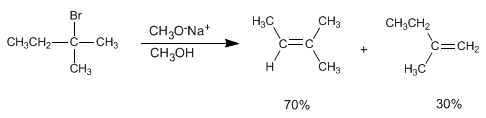

En esta eliminación se obtiene mayoritariamente el producto de mayor estabilidad (alqueno más sustituido), y se dice que sigue la regla de Saytzev.
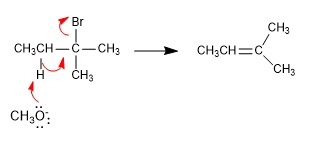
El metóxido, base pequeña, sustrae el hidrógeno más interno del haloalcano para generar el producto más estable (alqueno termodinámico)

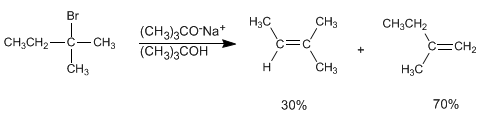
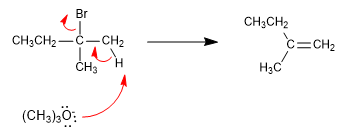
Si empleamos como base tert-butóxido o LDA el alqueno formado mayoritariamente es el 2-metil-1-buteno. Las bases impedidas tienen dificultades para acceder al hidrógeno más interno, sustrayendo más rápido el hidrógeno más accesible, por lo que generan el producto menos estable mayoritariamete. En este caso la reacción se controla cinéticamente y se de que sigue la regla de Hofmann.

Los hidrógenos situados sobre metilos son más accesibles para el tert-butóxido que los internos. El alqueno formado mayoritariamente es el menos sustituido.

Síntesis de alquenos por deshidratacion de alcoholes
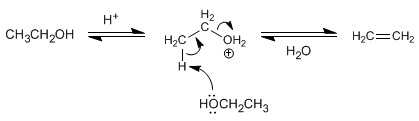
El tratamiento de alcoholes con ácidos minerales a elevadas temperaturas provoca la pérdida e agua, que transcurre a través de mecanismos E1 o E2.
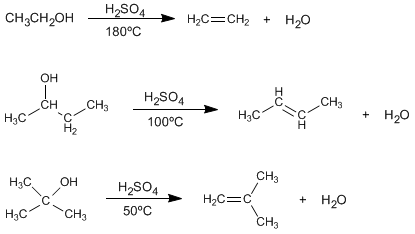
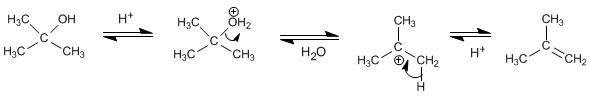

En las condiciones de reacción, se observa que los alcoholes terciarios deshidratan mejor que los secundarios, y estos a su vez mejor que los primarios.
Mecanismo para la deshidratación de alcoholes primarios
Los alcoholes primarios deshidratan mediante mecanismo E2

Mecanismo de la deshidratación de alcoholes secundarios o terciarios
Los alcoholes secundarios y terciarios forman carbocationes estables por pérdida de una molécula de agua previa protonación del grupo hidroxilo. El carbocatión formado genera el alqueno por pérdida de un protón.
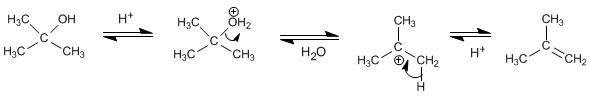
ALQUINOS.
Son hidrocarburos insaturados tambien llamados hidrocarburos acetilenicos, derivados de un primer miembro con el nombre de acetileno.
Estructurados
por un triple enlace carbono-carbono, tal y como se demuestra en la imagen.
Dichos hidrocarburos al igual que alcanos y alquenos, cuentan con una formula general: CnH2n-2.
NOMENCLATURA.
Tomemos en cuenta que se usan las reglas de la IUPAC, las cuales se emplean tambien en los alquenos, cambiando la terminacion eno por ino. A continuacion, mencionamos los pasos mas sencillos para nombrar de forma simple alos alquinos:
- Tomamos la cadena continua mas larga, que cuente con las ligaduras mas cercanas y las enumeramos (no olvides que los esqueletos pueden ennumerarse izquierda a derecha, y de derecha a izquierda).
- La cadena se nombra con la terminacion ino, especificando tambien el numero de atomos de carbono de dicho esqueleto con un prefijo (et- dos, prop- tres, but- cuatro; pent-; hex-; etc).
- Si fuese necesario, la posicion donde se encuentre el triple enlace se indica mediante el menor numero correspondiente a uno de sus atomos de carbono de la triple ligadura, situando a dicho numero antes de la terminacion -ino. Ej. : CH3-CH2-CH2-CH2-C≡C-CH3, hept-2-ino.
- Recordemos, cuando hay mas de un triple enlace, se nombra con preficjos de acuerdo al numero de triple ligaduras que haya, di, tri, tetra... Ej.: octa-1,3,5,7-tetraino, CH≡C-C≡C-C≡C-C≡CH.
- Ahora, si hay existen dobles y triples enlaces, se da el número más bajo al doble enlace. Ej.: pent-2-en-4-ino, CH3-CH=CH-C≡CH.
- Los sustituyentes tales como átomos de halógeno o grupos alquilo se indican mediante su nombre y un número, de la misma forma que para el caso de los alcanos. Ej.: 3-cloropropino, CH≡C-CH2Cl; 2,5-dimetilhex-3-ino, CH3-C(CH3)-C≡C-C(CH3)-CH3.
CH CH etino(acetileno) CH3–C
CH etino(acetileno) CH3–C CH propino
CH3–CH2–C
CH propino
CH3–CH2–C CH 1-butino CH3-C
CH 1-butino CH3-C C-CH3 2-butino
CH
C-CH3 2-butino
CH C- etinilo CH
C- etinilo CH C-CH2– 2-propinilo
CH3–C
C-CH2– 2-propinilo
CH3–C C- 1-propinino CH3–CH2–CH2–C
C- 1-propinino CH3–CH2–CH2–C CH 1-pentino
CH 1-pentino
PROPIEDADES FISICAS. Gaseaosos C4
Liquidos C15
Solidos C16 (en adelante).
Contienen un punto de ebullicion mucho mas elevado que los alquenos, ademas no son
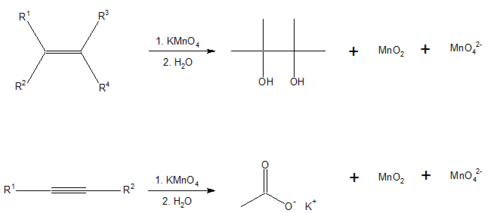
PROPIEDADES QUIMICAS. Reducen el
permanganato de potasio en medio neutro, por medio de la prueba de Bayer.
en una solucion alcalina
de permanganato de potasio;
dicha reaccion con doble
(-C=C-)o triple ligadura
(-C≡C-), en un material
organico, ocasiona que el
color purpura-rosado se
torne a marron.
METODOS DE OBTENCION.
Implica varios procesos:
- Primeramente, se utilizan derivados di halogenados de carbones relacionados con un hidroxido que se encuentre en solucion alcoholica.
- Despues, tratamos derivados tetra halogenados en carbono relacionados con metales.
USOS Y APLICACIONES.
- Utilizados como combustibles
- Materia prima (usado en sintesis de polimerizacion para obtener diversos plasticos)
- Aplicados en la partida d productos sintetizados a partir del PVC
- Presente en farmacos citostaticos.
CICLOALCANOS.
Cuentan con una formula general: CnH2n
Nomeclatura
Nombrados al igual que los hidrocarburos de cadena abierta
con el mismo numero de carbonos que el anillo,anteponiendo el prefijo ciclo.
Estructura de los cicloalcanos
Se representan con figuras geometricas simples, de acuerdo al numero de carbonos que presenta su estructura correspondiente, es decir, para comprender esto, para relizar el esqueleto del ciclopropano usaremos el triangulo, para el ciclobutano, el cuadro, para el cilopentano un pentagono, el ciclohexano un hexagono, y asi sucesivamente...(Se puede observar esta aplicacion en la imagen de arriba).
Cada vertice de la figura correspondiente a cualquiera de los cicloalcanos contiene dos hidrogenos, a menos que sea una arborescencia.
Cabe recordar que la estructura de los cicloalcanos pueden presentar compuestos policiclicos, los cuales contienes dos o mas anillos que comparten dos o mas atomos de carbono.
Este sistema, el sistema policiclico alifatico maximo es el diamante, pero eso si, el diamante no es un hidrocarburo, mas bien es una forma alotropica de carbono elemental.
Los carbonos del diamante estan unidos a otros cuatro por medio de enlaces tetraedricos.
PROPIEDADES FISICAS.
Se asemejan a la de los alcanos, tienen un punto de ebullicion y densidad mayor que un hidrocarburo saturado de cadena abierta teniendo igual numero de atomos de carbono.
PROPIEDADES QUIMICAS.
Dan reacciones identicas de susticion como los alcanos; estas reacciones destruyen el ciclo y dan como resultado productos de cadena abierta.
Solamente el ciclobutano da una reaccion de adicion con el hidrogeno.
METODOS DE OBTENCION.
- METODO INDUSTRIAL. Los cicloalcanos mas estables (ciclohexano, ciclopentano), son mas abundantes naturalmente constituyendo petroleos del Caucaso. Los mas interesantes son los que tienen un anillo de seis atomos de carbono, comunmente llamado terpeno, abundantes en esncias vegetales.
- METODOS DE LABORATORIO. Tratados con sodio, a partir de derivados di halogenados.
USOS Y APLICACIONES.
- Practicado en incisiones de algunas especies de pino, agregando trementinas, sometidas a destilacion a traves de corriente de vapor de agua resultando esencia trementina y colofina.
- Forman parte de la gasolina.
- Utilizados como disolventes.
AROMATICOS
Los hidrocarburos aromáticos son aquellos hidrocarburos que
poseen las propiedades especiales asociadas con el núcleo o anillo
del benceno, en el cual hay seis grupos de carbono-hidrógeno
unidos a cada uno de los vértices de un hexágono.

Los enlaces que unen estos seis grupos al anillo presentan características intermedias, respecto a su comportamiento, entre los enlaces simples y los dobles. Así, aunque el benceno puede reaccionar para formar productos de adición, como el ciclohexano, la reacción característica del benceno no es una reacción de adición, sino de sustitución, en la cual el hidrógeno es reemplazado por otro sustituto, ya sea un elemento univalente o un grupo.
Los hidrocarburos aromáticos y sus derivados son compuestos cuyas moléculas están formadas por una o más estructuras de anillo estables del tipo antes descrito y pueden considerarse derivados del benceno de acuerdo con tres procesos básicos:
1. por sustitución de los átomos de hidrógeno por radicales de
hidrocarburos alifáticos,
2. por la unión de dos o más anillos de benceno, ya sea directamente o mediante cadenas alifáticas u otros radicales intermedios,
3. por condensación de los anillos de benceno.
Cada una de las estructuras anulares puede constituir la base
de series homólogas de hidrocarburos, en las que una sucesión de
grupos alquilo, saturados o no saturados, sustituye a uno o más
átomos de hidrógeno de los grupos de carbono-hidrógeno.
Las principales fuentes de hidrocarburos aromáticos son la
destilación de la hulla y una serie de procesos petroquímicos, en
particular la destilación catalítica, la destilación del petróleo
crudo y la alquilación de hidrocarburos aromáticos de las series
más bajas. Los aceites esenciales, que contienen terpenos y p-cimeno, también pueden obtenerse de los pinos, los eucaliptos y las
plantas aromáticas y son un subproducto de las industrias papeleras que utilizan pulpa de pino. Los hidrocarburos policíclicos se
encuentran en las atmósferas urbanas.
Usos
La importancia económica de los hidrocarburos aromáticos ha
aumentado progresivamente desde que a principios del siglo XIX
se utilizaba la nafta de alquitrán de hulla como disolvente del
caucho. En la actualidad, los principales usos de los compuestos
aromáticos como productos puros son: la síntesis química de plásticos, caucho sintético, pinturas, pigmentos, explosivos, pesticidas,
detergentes, perfumes y fármacos. También se utilizan, principalmente en forma de mezclas, como disolventes y como constituyentes, en proporción variable, de la gasolina.
El cumeno se utiliza como componente de alto octanaje en los
combustibles de los aviones, como disolvente de pinturas y lacas
de celulosa, como materia prima para la síntesis de fenol
y acetona y para la producción de estireno por pirólisis. También
se encuentra en muchos disolventes comerciales derivados del
petróleo, con puntos de ebullición que oscilan entre 150 y
160 °C. Es un buen disolvente de grasas y resinas y, por este
motivo, se ha utilizado como sustituto del benceno en muchos de
sus usos industriales. El p-cimeno se encuentra en muchos aceites
esenciales y se puede obtener porhidrogenación de los terpenos
monocíclicos. Es un subproducto del proceso de fabricación de
pasta de papel al sulfito y se utiliza principalmente, junto con
otros disolventes e hidrocarburos aromáticos, como diluyente de
lacas y barnices.
La cumarina se utiliza como desodorante o como potenciador
del olor en jabones, tabaco, productos de caucho y perfumes.
También se utiliza en preparados farmacéuticos.
El benceno se ha prohibido como componente de productos
destinados al uso doméstico y en muchos países también se ha
prohibido su uso como disolvente y componente de los líquidos
de limpieza en seco. El benceno se ha utilizado ampliamente en
la fabricación de estireno, fenoles, anhídrido maleico, detergentes, explosivos, productos farmacéuticos y colorantes.
También se ha empleado como combustible, reactivo químico
y agente de extracción para semillas y frutos secos. Los derivados
mono, di y trialquilados del benceno se utilizan principalmente
como disolventes y diluyentes y en la fabricación de perfumes y
productos intermedios en la producción de colorantes. Estas
sustancias se encuentran en algunos petróleos y en los destilados
del alquitrán de hulla. El pseudocumeno se utiliza en la fabricación
de perfumes y el 1,3,5-trimetilbenceno y el pseudocumeno se
emplean también como productos intermedios en la producción
de colorantes, aunque el uso industrial más importante de estas
sustancias es como disolventes y diluyentes de pinturas.
El tolueno es un disolvente de aceites, resinas, caucho natural
(mezclado con ciclohexano) y sintético, alquitrán de hulla, asfalto,
brea y acetilcelulosas (en caliente, mezclado con etanol).
También se utiliza como disolvente y diluyente de pinturas y
barnices de celulosa y como diluyente de las tintas de fotograbado. Al mezclarse con el agua, forma mezclas azeotrópicas que
tienen un efecto deslustrante. El tolueno se encuentra en mezclas
que se utilizan como productos de limpieza en distintas industrias
y en artesanía. También se utiliza en la fabricación de detergentes y cuero artificial y es una importante materia prima
para síntesis orgánicas, como las de cloruro de benzoilo y bencilideno, sacarina, cloramina T, trinitrotolueno y un gran número
de colorantes. El tolueno es un componente del combustible para
aviones y de la gasolina para automóviles. El Reglamento
594/91/CE del Consejo ha prohibido el uso de esta sustancia en
la Unión Europea.
El naftaleno se utiliza como material de partida para la síntesis
orgánica de una amplia gama de sustancias químicas, como antipolillas, y en conservantes de madera. También se emplea en la
fabricación de índigo y se aplica externamente al ganado o las
aves para controlar los insectos parásitos.
El estireno se utiliza en la fabricación de una amplia gama de
polímeros (como el poliestireno) y elastómeros copolímeros, como
el caucho de butadieno-estireno o el acrilonitrilo-butadieno-estireno (ABS), que se obtienen mediante la copolimerización del
estireno con 1,3-butadieno y acrilonitrilo. El estireno se utiliza
ampliamente en la producción de plásticos transparentes. El etilbenceno es un producto intermedio en síntesis orgánicas, especialmente en la producción de estireno y caucho sintético. Se utiliza
como disolvente o diluyente, como componente de los combustibles para automóviles y aviones y en la fabricación de acetato de
celulosa.
Existen tres isómeros del xileno: orto- (o-), para- (p-) y meta- (m-). El
producto comercial es una mezcla de estos isómeros, con el
isómero meta- en mayor proporción (hasta un 60 a 70 %) y
el para- en menor proporción (hasta un 5 %). El xileno se utiliza
como diluyente de pinturas y barnices, en productos farmacéuticos, como aditivo de alto octanaje en combustibles de aviones,
en la síntesis de colorantes y en la producción de ácidos ftálicos.
Debido a que el xileno es un buen disolvente de la parafina, el
104.282 HIDROCARBUROS AROMATICOS ENCICLOPEDIA DE SALUD Y SEGURIDAD EN EL TRABAJO
GUIASbálsamo de Canadá y el poliestireno, también se utiliza en
histología.
Los terfenilos se utilizan como productos químicos intermedios
en la producción de lubricantes densos y como refrigerantes en
los reactores nucleares. Los terfenilos y difenilos se utilizan como
agentes de transferencia de calor, en síntesis orgánicas y en la
fabricación de perfumes. El difenilmetano, por ejemplo, se utiliza
como perfume en la industria del jabón y como disolvente de
lacas de celulosa. También tiene algunas aplicaciones como
pesticida.
Riesgos
La absorción de los hidrocarburos aromáticos tiene lugar por
inhalación, ingestión y, en cantidades pequeñas, por vía cutánea.
En general, los derivados monoalquilados del benceno son más
tóxicos que los dialquilados, y los derivados de cadena ramificada
son más tóxicos que los de cadena simple. Los hidrocarburos
aromáticos se metabolizan mediante la biooxidación del anillo. Si
existen cadenas laterales, preferiblemente de grupos metilo, éstas
se oxidan y el anillo permanece sin modificar. En gran parte se
convierten en compuestos hidrosolubles y posteriormente
se conjugan con glicina, ácido glucurónico o ácido sulfúrico
y se eliminan en la orina.
Los hidrocarburos aromáticos pueden causar efectos agudos y
crónicos en el sistema nervioso central. La intoxicación aguda
por estos compuestos produce cefalea, náuseas, mareo, desorientación, confusión e inquietud. La exposición aguda a dosis altas
puede incluso provocar pérdida de consciencia y depresión respiratoria. Uno de los efectos agudos más conocidos es la irritación
respiratoria (tos y dolor de garganta). También se han observado
síntomas cardiovasculares, como palpitaciones y mareos. Los
síntomas neurológicos de la exposición crónica pueden ser:
cambios de conducta, depresión, alteraciones del estado de
ánimo y cambios de la personalidad y de la función intelectual.
También se sabe que la exposición crónica produce o contribuye
a producir neuropatía distal en algunos pacientes. El tolueno se
ha asociado con un síndrome persistente de ataxia cerebelar.
Otros efectos crónicos son sequedad, irritación y agrietamiento
de la piel y dermatitis. La exposición, sobre todo a los compuestos
clorados de este grupo, puede causar hepatotoxicidad. El
benceno es un carcinógeno humano demostrado que favorece
el desarrollo de todo tipo de leucemias y, en particular, de la
leucemia no linfocítica aguda. También puede causar anemia
aplástica y pancitopenia reversible.
Los hidrocarburos aromáticos, en conjunto, entrañan un riesgo
considerable de ignición. La National Fire Prevention Association
(NFPA) de Estados Unidos ha clasificado a la mayoría de los
compuestos de este grupo con un código de inflamabilidad de 3
(donde 4 representa un riesgo grave). Con estas sustancias deben
adoptarse las medidas necesarias para evitar la acumulación de
vapores en los lugares de trabajo y para atacar rápidamente las
fugas y los derrames. En presencia de vapores se deben evitar
las fuentes de calor extremo.
Benceno
El benceno se conoce generalmente como “Benzol” cuando se
encuentra en forma comercial (que es una mezcla de benceno y
sus homólogos) y no debe confundirse con la bencina, un disolvente comercial compuesto por una mezcla de hidrocarburos
alifáticos.
Mecanismo de acción. La absorción del benceno tiene lugar principalmente por vía respiratoria y digestiva. Esta sustancia no
penetra fácilmente por vía cutánea, a menos que la exposición
sea excepcionalmente alta. Una pequeña cantidad del benceno se
exhala sin cambios. El benceno se distribuye ampliamente por
todo el organismo y se metaboliza principalmente en fenol, que
se excreta en la orina tras su conjugación. Una vez que cesa la
exposición, los niveles en los tejidos corporales disminuyen
rápidamente.
Desde el punto de vista biológico, parece ser que las alteraciones hemáticas y de la médula ósea encontradas en los casos de
intoxicación crónica con benceno pueden atribuirse a la conversión del benceno en epóxido de benceno. Se ha sugerido que el
benceno podría oxidarse directamente a epóxido en las células de
la médula ósea, como los eritroblastos. En lo que se refiere al
mecanismo de toxicidad, los metabolitos del benceno parecen
interferir con los ácidos nucléicos. Tanto en las personas como en
los animales expuestos al benceno, se ha detectado un aumento
de la frecuencia de aberraciones cromosómicas. Cualquier factor
que inhiba el metabolismo del epóxido de benceno y las reacciones de conjugación, especialmente las alteraciones hepáticas,
tenderá a potenciar los efectos tóxicos del benceno. Estos factores
son importantes cuando se consideran las susceptibilidades individuales a este agente tóxico. El benceno se trata con más detalle
en otros artículos de esta Enciclopedia.
Incendio y explosión. El benceno es un líquido inflamable y sus
vapores forman mezclas inflamables o explosivas con el aire en
una amplia gama de concentraciones. El benceno líquido puede
emitir vapores a temperaturas tan bajas como -11 °C. Por ello, si
no se observan las necesarias precauciones durante el almacenamiento, la manipulación o el uso del benceno líquido, es seguro
que, a las temperaturas normales de trabajo, se formarán concentraciones inflamables. Este riesgo aumentará cuando se
produzcan salpicaduras o derrames accidentales.
Tolueno y sus derivados
Metabolismo. El tolueno se absorbe en el organismo principalmente a través del tracto respiratorio y, en menor proporción,
a través de la piel. Traspasa la membrana alveolar. La mezcla
sangre/aire se mantiene en una proporción de 11,2 a 15,6 a
37 °C y, entonces, se distribuye por los distintos tejidos en cantidades variables que dependen de sus características de perfusión
y solubilidad, respectivamente. La proporción tejido/sangre es de
1:3, excepto en el caso de los tejidos ricos en grasas, que
presentan un coeficiente de 80/100. A continuación, el tolueno
es oxidado en su cadena lateral por los microsomas hepáticos
(mono-oxigenación microsomal). El producto más importante de
esta transformación, que representa aproximadamente un 68 %
del tolueno absorbido, es el ácido hipúrico (AH), que aparece en
la orina debido a la excreción renal que suele producirse en los
túbulos proximales. También pueden detectarse en la orina
pequeñas cantidades de o-cresol (0,1 %) y p-cresol (1 %), como
resultado de la oxidación del núcleo aromático, según se explica
en el Capítulo Control biológico de esta Enciclopedia.
La vida media biológica del AH es muy corta, del orden de 1 a
2 horas. El nivel de tolueno en el aire espirado, en reposo, es del
orden de 18 ppm durante una exposición a 100 ppm, y disminuye rápidamente al cesar la exposición. La cantidad de tolueno
retenida en el organismo está en función del porcentaje de grasa
presente. Las personas obesas retienen más tolueno que las
delgadas.
En el hígado, los mismos sistemas enzimáticos son los encargados de oxidar el tolueno, el estireno y el benceno. Por ello,
estas tres sustancias tienden a inhibirse mutuamente de forma
competitiva. Si se administra a ratas una cantidad importante de
tolueno y benceno, se observa una disminución de la concentración de los metabolitos del benceno en los tejidos y en la orina y
un aumento de benceno en el aire espirado. En el caso del tricloroetileno, la inhibición no es competitiva, ya que estas dos sustancias no son oxidadas por el mismo sistema enzimático. La exposición simultánea produce una disminución del AH y
la aparición de compuestos triclorados en la orina.